PRP moderno: “PRP clínico”
Nos últimos 10 anos, o esquema de tratamento do PRP passou por grandes mudanças.Através de pesquisas experimentais e clínicas, agora temos uma melhor compreensão da fisiologia das plaquetas e de outras células.Além disso, diversas avaliações sistemáticas de alta qualidade, meta-análises e ensaios clínicos randomizados demonstraram a eficácia da biotecnologia PRP em muitas áreas médicas, incluindo dermatologia, cirurgia cardíaca, cirurgia plástica, cirurgia ortopédica, tratamento da dor, doenças da coluna vertebral e medicina esportiva. .
A característica atual do PRP é sua concentração absoluta de plaquetas, que varia da definição inicial de PRP (incluindo concentração plaquetária superior ao valor basal) para mais de 1 × 10 6/µ L ou cerca de 5 vezes a concentração mínima de plaquetas em plaquetas de linha de base.Na extensa revisão de Fadadu et al.Foram avaliados 33 sistemas e protocolos de PRP.A contagem de plaquetas da preparação final de PRP produzida por alguns destes sistemas é inferior à do sangue total.Eles relataram que o fator plaquetário do PRP aumentou até 0,52 com o kit de giro único (Selphyl ®).Em contraste, EmCyte Genesis PurePRPII ® de dupla rotação A concentração de plaquetas produzida pelo dispositivo é a mais alta (1,6 × 10 6 /µL).
Obviamente, os métodos in vitro e animais não são o ambiente de investigação ideal para uma transformação bem sucedida na prática clínica.Da mesma forma, o estudo de comparação de dispositivos não apoia a decisão, pois mostra que a concentração de plaquetas entre dispositivos de PRP é muito diferente.Felizmente, através de tecnologia e análise baseadas em proteômica, podemos aumentar nossa compreensão das funções celulares no PRP que afetam os resultados do tratamento.Antes de chegar a um consenso sobre preparações e formulações padronizadas de PRP, o PRP deve seguir as formulações clínicas de PRP para promover mecanismos substanciais de reparo tecidual e resultados clínicos progressivos.
Fórmula clínica de PRP
Atualmente, o PRP clínico eficaz (C-PRP) tem sido caracterizado como uma composição complexa de componentes multicelulares autólogos em plasma de pequeno volume obtido de uma parte do sangue periférico após centrifugação.Após a centrifugação, o PRP e seus componentes celulares não plaquetários podem ser recuperados do dispositivo de concentração de acordo com diferentes densidades celulares (das quais a densidade plaquetária é a mais baixa).
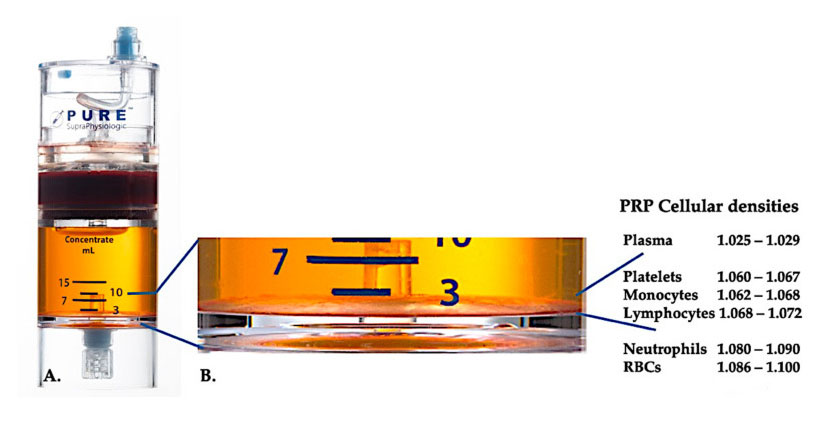
Use PurePRP-SP ® Equipamento de separação por densidade celular (EmCyte Corporation, Fort Myers, FL, EUA) foi usado para sangue total após dois procedimentos de centrifugação.Após o primeiro processo de centrifugação, o hemocomponente total foi separado em duas camadas básicas, suspensão de plasma de plaquetas (magra) e camada de glóbulos vermelhos.Em A, a segunda etapa de centrifugação foi concluída.O volume real do PRP pode ser extraído para aplicação no paciente.A ampliação em B mostra que há uma camada marrom de hemossedimentação multicomponente organizada (representada pela linha azul) na parte inferior do equipamento, que contém altas concentrações de plaquetas, monócitos e linfócitos, com base no gradiente de densidade.Neste exemplo, de acordo com o protocolo de preparação de C-PRP com neutrófilos pobres, será extraída a percentagem mínima de neutrófilos (<0,3%) e eritrócitos (<0,1%).
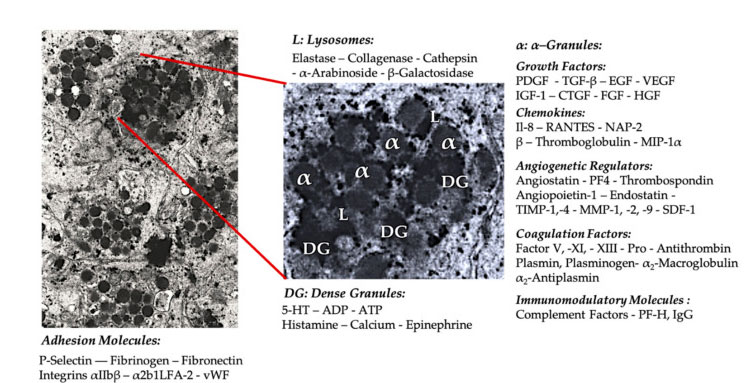
Grânulo de plaquetas
Na aplicação clínica inicial do PRP, os α-grânulos são a estrutura interna das plaquetas mais comumente citada, porque contêm fatores de coagulação, um grande número de PDGF e reguladores angiogênicos, mas têm pouca função trombogênica.Outros fatores incluem componentes menos conhecidos de quimiocinas e citocinas, como fator plaquetário 4 (PF4), proteína básica pré-plaquetária, P-selectina (um ativador de integrina) e quimiocina RANTES (regulada por ativação, expressando células T normais e presumivelmente secretando).A função geral desses componentes específicos dos grânulos plaquetários é recrutar e ativar outras células do sistema imunológico ou induzir inflamação das células endoteliais.
Componentes granulares densos como ADP, serotonina, polifosfato, histamina e adrenalina são usados mais implicitamente como reguladores da ativação plaquetária e trombose.Mais importante ainda, muitos desses elementos têm a função de modificar as células do sistema imunológico.O ADP plaquetário é reconhecido pelo receptor P2Y12ADP nas células dendríticas (DC), aumentando assim a endocitose do antígeno.DC (célula apresentadora de antígeno) é muito importante para iniciar a resposta imune das células T e controlar a resposta imune protetora, que liga o sistema imunológico inato e o sistema imunológico adaptativo.Além disso, o trifosfato de adenosina plaquetário (ATP) envia sinais através do receptor de células T P2X7, levando ao aumento da diferenciação de células T auxiliares CD4 em células T auxiliares pró-inflamatórias 17 (Th17).Outros componentes granulares densos em plaquetas (como glutamato e serotonina) induzem a migração de células T e aumentam a diferenciação de monócitos em DC, respectivamente.No PRP, esses imunomoduladores derivados de partículas densas são altamente enriquecidos e possuem funções imunológicas substanciais.
O número de potenciais interações diretas e indiretas entre plaquetas e outras células (receptoras) é extenso.Portanto, a aplicação de PRP no ambiente tecidual patológico local pode induzir uma variedade de efeitos inflamatórios.
Concentração de plaquetas
O C-PRP deve conter doses clínicas de plaquetas concentradas para produzir efeitos terapêuticos benéficos.As plaquetas no C-PRP devem estimular a proliferação celular, a síntese de fatores mesenquimais e neurotróficos, promover a migração de células quimiotáticas e estimular a atividade imunorreguladora, conforme mostrado na figura.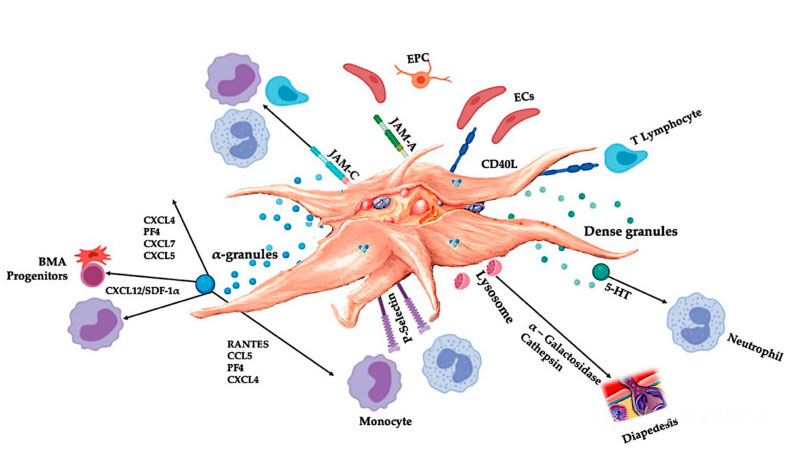
Plaquetas ativadas, liberação de PGF e moléculas de adesão medeiam uma variedade de interações celulares: quimiotaxia, adesão celular, migração e diferenciação celular, e regulam atividades regulatórias imunológicas.Essas interações plaquetas-células contribuem para a angiogênese e a atividade inflamatória e, em última análise, estimulam o processo de reparo tecidual.Abreviaturas: BMA: aspirado de medula óssea, EPC: células progenitoras endoteliais, EC: células endoteliais, 5-HT: 5-hidroxitriptamina, RANTES: regulação ativada da expressão normal de células T e secreção putativa, JAM: tipo de molécula de adesão de junção, CD40L: cluster Ligante 40, SDF-1 α: Fator 1 α derivado de células estromais, CXCL: ligante de quimiocina (motivo CXC), PF4: fator plaquetário 4. Adaptado de Everts et al.
Marx foi a primeira pessoa a provar que a cicatrização óssea e de tecidos moles foi melhorada, e a contagem mínima de plaquetas foi de 1 × 10 6 /µL。 Esses resultados foram confirmados em um estudo de fusão lombar através do forame intervertebral, quando a dose de plaquetas foi maior que 1,3 × Com 106 plaquetas/µL, este estudo demonstrou maior fusão.Além disso, Giusti et al.Revelado 1,5 × O mecanismo de reparo tecidual na dose de 109 requer plaquetas/mL para induzir angiogênese funcional por meio da atividade das células endoteliais.Neste último estudo, concentrações mais elevadas reduziram o potencial de angiogênese das plaquetas dentro e ao redor dos folículos.Além disso, dados anteriores mostraram que a dose de PRP também afetaria os resultados do tratamento.Portanto, a fim de induzir significativamente a reação de angiogênese e estimular a proliferação celular e a migração celular, o C-PRP deve conter pelo menos 7,5 em um frasco de tratamento de 5 mL de PRP. × 10 9 podem liberar plaquetas.
Além da dependência da dose, o efeito do PRP na atividade celular parece ser altamente dependente do tempo.Sofia et al.Estes resultados sugerem que a exposição a curto prazo a lisados de plaquetas humanas pode estimular a proliferação de células ósseas e a quimiotaxia.Pelo contrário, a exposição prolongada ao PRP levará a níveis mais baixos de fosfatase alcalina e à formação de minerais.
hemácia
Os glóbulos vermelhos são responsáveis pelo transporte de oxigênio para os tecidos e pela transferência de dióxido de carbono dos tecidos para os pulmões.Eles não têm núcleo e são compostos de moléculas heme que se ligam a proteínas.Os componentes de ferro e heme nos glóbulos vermelhos promovem a combinação de oxigênio e dióxido de carbono.Geralmente, o ciclo de vida dos glóbulos vermelhos é de cerca de 120 dias.Eles são removidos da circulação pelos macrófagos por meio de um processo denominado envelhecimento dos glóbulos vermelhos.Os glóbulos vermelhos em amostras de PRP podem ser danificados sob condições de cisalhamento (por exemplo, cirurgia de sangramento de sangue total, processo imunomediado, estresse oxidativo ou esquema inadequado de concentração de PRP).Portanto, a membrana celular das hemácias se decompõe e libera hemoglobina tóxica (Hb), medida pela hemoglobina livre no plasma (PFH), heme e ferro.].O PFH e seus produtos de degradação (heme e ferro) levam conjuntamente a efeitos nocivos e citotóxicos nos tecidos, levando ao estresse oxidativo, perda de óxido nítrico, ativação de vias inflamatórias e imunossupressão.Esses efeitos acabarão por levar à disfunção da microcirculação, vasoconstrição local e lesão vascular, bem como sérios danos aos tecidos.
O mais importante é que quando os glóbulos vermelhos contendo C-PRP são entregues ao tecido, causará uma reação local chamada eriptose, que desencadeará a liberação de um inibidor eficaz da migração de citocinas e macrófagos.Esta citocina inibe a migração de monócitos e macrófagos.Exerce fortes sinais pró-inflamatórios aos tecidos circundantes, inibe a migração de células-tronco e a proliferação de fibroblastos e leva a uma disfunção celular local significativa.Portanto, é importante limitar a contaminação por hemácias nas preparações de PRP.Além disso, o papel dos glóbulos vermelhos na regeneração dos tecidos nunca foi determinado.O processo adequado de centrifugação e preparação do C-PRP geralmente reduzirá ou até eliminará a presença de glóbulos vermelhos, evitando assim as consequências adversas da hemólise e da policitemia.
Leucócitos em C-PRP
A presença de glóbulos brancos nas preparações de PRP depende do equipamento de tratamento e do esquema de preparação.Em equipamentos de PRP baseados em plasma, os glóbulos brancos são completamente eliminados;No entanto, os glóbulos brancos estavam significativamente concentrados na preparação de PRP da camada marrom de sedimentação de eritrócitos.Devido aos seus mecanismos de defesa imunológica e do hospedeiro, os glóbulos brancos afetam grandemente a biologia interna de condições teciduais agudas e crônicas.Esses recursos serão discutidos mais adiante.Portanto, a presença de leucócitos específicos no C-PRP pode causar efeitos celulares e teciduais significativos.Mais especificamente, diferentes sistemas de camada marrom-amarela de sedimentação de eritrócitos do PRP utilizam diferentes esquemas de preparação, produzindo assim diferentes proporções de neutrófilos, linfócitos e monócitos no PRP.Eosinófilos e basófilos não podem ser medidos em preparações de PRP porque as suas membranas celulares são demasiado frágeis para suportar forças de processamento centrífugas.
Neutrófilos
Os neutrófilos são leucócitos essenciais em muitas vias de cura.Estas vias combinam-se com proteínas antimicrobianas presentes nas plaquetas para formar uma barreira densa contra patógenos invasivos.A existência de neutrófilos é determinada de acordo com o alvo do tratamento do C-PRP.Níveis aumentados de inflamação tecidual podem ser necessários na bioterapia PRP para tratamento de feridas crônicas ou em aplicações destinadas ao crescimento ou cicatrização óssea.É importante ressaltar que funções adicionais de neutrófilos foram encontradas em vários modelos, enfatizando seu papel na angiogênese e no reparo tecidual.No entanto, os neutrófilos também podem causar efeitos nocivos, por isso não são adequados para algumas aplicações.Zhou e Wang provaram que o uso de PRP rico em neutrófilos pode levar a um aumento na proporção de colágeno tipo III em relação ao colágeno tipo I, exacerbando assim a fibrose e reduzindo a força do tendão.Outras características prejudiciais mediadas pelos neutrófilos são a liberação de citocinas inflamatórias e metaloproteinases de matriz (MMPs), que podem promover inflamação e catabolismo quando aplicadas aos tecidos.
Leucomonócitos
No C-PRP, os linfócitos mononucleares T e B estão mais concentrados do que quaisquer outros glóbulos brancos.Eles estão intimamente relacionados à imunidade adaptativa citotóxica mediada por células.Os linfócitos podem desencadear reações celulares para combater infecções e se adaptar aos invasores.Além disso, citocinas derivadas de linfócitos T (interferon-γ [IFN- γ] e interleucina-4 (IL-4) aumentam a polarização dos macrófagos. Verassar et al. Está provado que os linfócitos T convencionais podem promover indiretamente a cicatrização do tecido em o modelo de camundongo regulando a diferenciação de monócitos e macrófagos.
Monócito – célula de reparo multipotente
De acordo com o dispositivo de preparação de PRP utilizado, os monócitos podem sobressair ou não existir no frasco de tratamento de PRP.Infelizmente, o seu desempenho e capacidade de regeneração raramente são discutidos na literatura.Portanto, pouca atenção é dada aos monócitos no método de preparação ou na fórmula final.O grupo de monócitos é heterogêneo, originando-se de células progenitoras na medula óssea e transportados para tecidos periféricos através da via de células-tronco hematopoiéticas de acordo com a estimulação do microambiente.Durante a homeostase e a inflamação, os monócitos circulantes deixam a corrente sanguínea e são recrutados para tecidos lesionados ou degradados.Eles podem atuar como macrófagos (M Φ), células efetoras ou células progenitoras.Monócitos, macrófagos e células dendríticas representam o sistema fagocítico mononuclear (MPS). Uma característica típica da MPS é a plasticidade de seu padrão de expressão gênica e a sobreposição funcional entre esses tipos de células.Nos tecidos degenerados, macrófagos residentes, fatores de crescimento de ação local, citocinas pró-inflamatórias, células apoptóticas ou necróticas e produtos microbianos iniciam a diferenciação dos monócitos em grupos de células MPS.Suponha que quando o C-PRP contendo monócitos de alto rendimento é injetado no microambiente local da doença, é provável que os monócitos se diferenciem em M Φ para causar alterações celulares importantes.
De monócito a M Φ No processo de transformação, fenótipo M Φ específico.Nos últimos dez anos, foi desenvolvido um modelo que integra M Φ. O complexo mecanismo de ativação é descrito como a polarização de dois estados opostos: M Φ Fenótipo 1 (M Φ 1, ativação clássica) e M Φ Fenótipo 2 (M Φ 2, ativação alternativa).M Φ 1 é caracterizado pela secreção inflamatória de citocinas (IFN- γ) e óxido nítrico para produzir um mecanismo eficaz de eliminação de patógenos.M Φ O fenótipo também produz fator de crescimento endotelial vascular (VEGF) e fator de crescimento de fibroblastos (FGF).M Φ O fenótipo é composto por células anti-inflamatórias com alta fagocitose.M Φ 2 Produz componentes da matriz extracelular, angiogênese e quimiocinas, e interleucina 10 (IL-10).Além da defesa contra patógenos, M Φ Também pode reduzir a inflamação e promover a reparação tecidual.Vale ressaltar que M Φ 2 foi subdividido em M in vitro Φ 2a、M Φ 2b e M Φ 2. Depende do estímulo.A tradução in vivo destes subtipos é difícil porque o tecido pode conter grupos MΦ mistos.Curiosamente, com base nos sinais ambientais locais e nos níveis de IL-4, o M Φ 1 pró-inflamatório pode ser convertido para promover o reparo M Φ 2。 A partir desses dados, é razoável supor que existem altas concentrações de monócitos e preparações de M Φ C-PRP podem contribuir para uma melhor reparação tecidual porque possuem capacidade antiinflamatória de reparação tecidual e de transdução de sinal celular.
Definição confusa de fração de glóbulos brancos no PRP
A presença de glóbulos brancos nos frascos de tratamento com PRP depende do dispositivo de preparação do PRP e pode apresentar diferenças significativas.Há muitas controvérsias sobre a existência de leucócitos e sua contribuição para diferentes produtos sub-PRP (como PRGF, P-PRP, LP-PRP, LR-PRP, P-PRF e L-PRF). ensaios controlados (nível de evidência 1) e três estudos comparativos prospectivos (nível de evidência 2) envolveram 1.055 pacientes, indicando que LR-PRP e LP-PRP tinham segurança semelhante.O autor concluiu que a reação adversa do PRP pode não estar diretamente relacionada à concentração de glóbulos brancos.Em outro estudo, o LR-PRP não alterou a interleucina inflamatória (IL-1) no joelho com OA (β、 IL-6, IL-8 e IL-17).Estes resultados apoiam a ideia de que o papel dos leucócitos na actividade biológica do PRP in vivo pode advir do crosstalk entre plaquetas e leucócitos.Esta interação pode promover a biossíntese de outros fatores (como o lipoxigênio), que podem compensar ou promover a regressão da inflamação.Após a liberação inicial de moléculas inflamatórias (ácido araquidônico, leucotrieno e prostaglandina), o lipoxigênio A4 é liberado das plaquetas ativadas para prevenir a ativação dos neutrófilos.É neste ambiente que o fenótipo M Φ de M Φ 1 muda para M Φ 2. Além disso, há evidências crescentes de que as células mononucleares circulantes podem se diferenciar em uma variedade de tipos de células não fagocíticas devido à sua pluripotência.
O tipo de PRP afetará a cultura do MSC.Comparado com amostras puras de PRP ou PPP, o LR-PRP pode induzir uma proliferação significativamente maior de MSCs derivadas da medula óssea (BMMSCs), com liberação mais rápida e melhor atividade biológica de PGF.Todas essas características conduzem à adição de monócitos ao frasco de tratamento de PRP e ao reconhecimento de sua capacidade imunomoduladora e potencial de diferenciação.
Regulação imunológica congênita e adaptativa do PRP
A função fisiológica mais famosa das plaquetas é controlar o sangramento.Eles se acumulam no local do dano tecidual e nos vasos sanguíneos danificados.Esses eventos são causados pela expressão de integrinas e selectinas que estimulam a adesão e agregação plaquetária.O endotélio danificado agrava ainda mais esse processo, e o colágeno exposto e outras proteínas da matriz subendotelial promovem a ativação profunda das plaquetas.Nestes casos, foi comprovado o importante papel da interação entre o fator de von Willebrand (vWF) e a glicoproteína (GP), especialmente GP-Ib.Após a ativação plaquetária, as plaquetas α-、 Densas, lisossomos e grânulos T regulam a exocitose e liberam seu conteúdo no ambiente extracelular.
Molécula de adesão plaquetária
A fim de compreender melhor o papel do PRP nos tecidos inflamatórios e nas plaquetas na resposta imune, devemos entender como diferentes receptores de superfície plaquetária (integrinas) e moléculas de adesão de junção (JAM) e interações celulares podem iniciar processos críticos na imunidade inata e adaptativa.
Integrinas são moléculas de adesão à superfície celular encontradas em vários tipos de células e expressas em grandes quantidades nas plaquetas.Integrinas incluem a5b1, a6b1, a2b1 LFA-2, (GPIa/IIa) e aIIbb3 (GPIIb/IIIa).Geralmente, eles existem em estado estático e de baixa afinidade.Após a ativação, eles mudam para o estado de alta afinidade de ligação ao ligante.As integrinas têm diferentes funções nas plaquetas e participam da interação das plaquetas com diversos tipos de glóbulos brancos, células endoteliais e matriz extracelular.Além disso, o complexo GP-Ib-V-IX é expresso na membrana plaquetária e é o principal receptor para ligação ao von vWF.Esta interação medeia o contato inicial entre as plaquetas e as estruturas subendoteliais expostas.A integrina plaquetária e o complexo GP estão relacionados a vários processos inflamatórios e desempenham um papel importante na formação do complexo plaquetas-leucócitos.Especificamente, a integrina aIIbb3 é necessária para formar um complexo estável combinando o fibrinogênio com o receptor do antígeno do macrófago 1 (Mac-1) nos neutrófilos.
Plaquetas, neutrófilos e células endoteliais vasculares expressam moléculas específicas de adesão celular, chamadas selectina.Sob condições inflamatórias, as plaquetas expressam a P-selectina e a L-selectina dos neutrófilos.Após a ativação plaquetária, a P-selectina pode ligar-se ao ligante PSGL-1 que existe em neutrófilos e monócitos.Além disso, a ligação do PSGL-1 inicia a reação em cascata do sinal intracelular, que ativa os neutrófilos através da integrina neutrofílica Mac-1 e do antígeno 1 relacionado à função linfocitária (LFA-1).Mac-1 ativado liga-se a GPIb ou GPIIb/IIIa nas plaquetas através do fibrinogênio, estabilizando assim a interação entre neutrófilos e plaquetas.Além disso, o LFA-1 ativado pode combinar-se com a molécula de adesão intercelular plaquetária 2 para estabilizar ainda mais o complexo neutrófilo-plaquetas e promover a adesão a longo prazo às células.
Plaquetas e leucócitos desempenham um papel fundamental nas respostas imunes inatas e adaptativas
O corpo pode reconhecer corpos estranhos e tecidos lesionados em doenças agudas ou crônicas para iniciar a reação em cascata de cicatrização de feridas e a via inflamatória.Os sistemas imunológicos inato e adaptativo protegem o hospedeiro contra infecções, e os glóbulos brancos desempenham um papel importante na sobreposição entre os dois sistemas.Especificamente, monócitos, macrófagos, neutrófilos e células natural killer desempenham um papel fundamental no sistema inato, enquanto os linfócitos e seus subconjuntos desempenham um papel semelhante no sistema imunológico adaptativo.
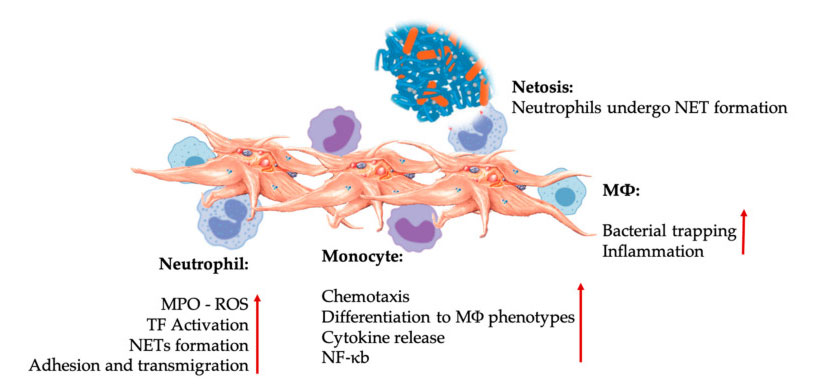
Interações de plaquetas e leucócitos em interações de células imunes inatas.As plaquetas interagem com neutrófilos e monócitos e, finalmente, com M Φ interagem, ajustam e aumentam suas funções efetoras.Essas interações plaquetas-leucócitos levam à inflamação através de diferentes mecanismos, incluindo NETose.Abreviaturas: MPO: mieloperoxidase, ROS: espécies reativas de oxigênio, TF: fator tecidual, NET: armadilha extracelular de neutrófilos, NF- κ B: fator nuclear kappa B, M Φ: Macrófagos.
Sistema imunológico inato
O papel do sistema imunológico inato é identificar de forma inespecífica microrganismos invasores ou fragmentos de tecido e estimular sua eliminação.Quando certas estruturas moleculares chamadas receptores de reconhecimento de padrões de expressão de superfície (PRRs) se combinam com padrões moleculares relacionados a patógenos e padrões moleculares relacionados a danos, o sistema imunológico inato será ativado.Existem muitos tipos de PRRs, incluindo o receptor Toll-like (TLR) e o receptor RIG-1 like (RLR).Esses receptores podem ativar o principal fator de transcrição kappa B (NF-κ B). Ele também regula múltiplos aspectos da resposta imune inata e adaptativa.Curiosamente, as plaquetas também expressam uma variedade de moléculas receptoras imunorreguladoras em sua superfície e citoplasma, como P-selectina, ligante da proteína transmembrana CD40 (CD40L), citocinas (como IL-1 β, TGF- β) e TLR específico de plaquetas. Portanto, as plaquetas podem interagir com diversas células do sistema imunológico.
Interação plaquetas-células brancas na imunidade inata
Quando as plaquetas entram ou invadem o fluxo sanguíneo ou o tecido, as plaquetas são uma das células que detectam primeiro a lesão endotelial e os patógenos microbianos.A agregação plaquetária promove a liberação dos agonistas plaquetários ADP, trombina e vWF, resultando na ativação plaquetária e na expressão dos receptores plaquetários de quimiocinas C, CC, CXC e CX3C, causando assim plaquetas no local infectado ou lesão.
O sistema imunológico inato é geneticamente predeterminado para detectar invasores, como vírus, bactérias, parasitas e toxinas, ou feridas e feridas em tecidos.É um sistema inespecífico, pois qualquer patógeno será identificado como estranho ou não próprio e rapidamente localizado.O sistema imunológico inato depende de um conjunto de proteínas e fagócitos, que reconhecem as características bem preservadas dos patógenos e ativam rapidamente a resposta imune para ajudar a eliminar invasores, mesmo que o hospedeiro nunca tenha sido exposto a patógenos específicos antes.
Neutrófilos, monócitos e células dendríticas são as células imunes inatas mais comuns no sangue.Seu recrutamento é necessário para uma resposta imunológica precoce adequada.Quando o PRP é usado na medicina regenerativa, a interação plaquetas-células brancas regula a inflamação, a cicatrização de feridas e a reparação de tecidos.O TLR-4 nas plaquetas estimula a interação plaquetas-neutrófilos, que regula a chamada explosão oxidativa de leucócitos, regulando a liberação de espécies reativas de oxigênio (ROS) e mieloperoxidase (MPO) dos neutrófilos.Além disso, a interação entre plaquetas-neutrófilos e desgranulação de neutrófilos leva à formação de armadilhas extracelulares de neutrófilos (NETs).Os NETs são compostos de núcleo de neutrófilos e outros conteúdos intracelulares de neutrófilos, que podem capturar bactérias e matá-las por meio de NETose.A formação de NETs é um mecanismo essencial de morte de neutrófilos.
Após a ativação plaquetária, os monócitos podem migrar para tecidos doentes e degenerativos, onde realizam atividades de adesão e secretam moléculas inflamatórias que podem alterar a quimiotaxia e as propriedades proteolíticas.Além disso, as plaquetas podem induzir a ativação do NF-κB dos monócitos para regular a função efetora dos monócitos, que é o principal mediador da resposta inflamatória e da ativação e diferenciação das células imunes.As plaquetas promovem ainda mais a explosão oxidativa endógena de monócitos para promover a destruição de patógenos fagocíticos.A liberação de MPO é mediada pela interação direta entre plaquetas-monócitos CD40L-MAC-1.Curiosamente, quando a P-selectina ativa as plaquetas sob condições teciduais inflamatórias agudas e crônicas, as quimiocinas derivadas de plaquetas PF4, RANTES, IL-1 β e CXCL-12 podem prevenir a apoptose espontânea de monócitos, mas promover sua diferenciação em macrófagos.
Sistema imunológico adaptativo
Depois que o sistema imunológico inato inespecífico reconhecer o dano microbiano ou tecidual, o sistema imunológico adaptativo específico assumirá o controle.Os sistemas adaptativos incluem linfócitos B de ligação ao antígeno (células B) e linfócitos T convencionais (Treg) que coordenam a eliminação de patógenos.As células T podem ser divididas em células T auxiliares (células Th) e células T citotóxicas (células Tc, também conhecidas como células T killer).As células Th são divididas em células Th1, Th2 e Th17, que desempenham funções essenciais na inflamação.As células Th podem secretar citocinas pró-inflamatórias (por exemplo, IFN-γ, TNF-β) e várias interleucinas (por exemplo, IL-17). Elas são particularmente eficazes na prevenção de vírus intracelulares e infecções bacterianas. As células Th estimulam a proliferação e diferenciação de células envolvidas em resposta imune.As células Tc são células efetoras, que podem eliminar microrganismos e células intracelulares e extracelulares alvo.
Curiosamente, as células Th2 produzem IL-4 e afetam a polarização M Φ, a regeneração guiada M Φ do fenótipo M Φ 2, enquanto o IFN- γ M Φ muda para o fenótipo inflamatório M Φ 1, que depende da dose e do tempo das citocinas.Após a ativação da IL-4, M Φ 2 induz as células Treg a se diferenciarem em células Th2 e, em seguida, produz IL-4 adicional (ciclo de feedback positivo).As células Th convertem M Φ O fenótipo é direcionado para o fenótipo regenerativo em resposta a agentes biológicos de origem tecidual.Este mecanismo é baseado na evidência de que as células Th desempenham um papel significativo no controle da inflamação e na reparação tecidual.
Interação plaquetas-células brancas na imunidade adaptativa
O sistema imunológico adaptativo utiliza receptores específicos de antígenos e lembra os patógenos encontrados anteriormente, e os destrói quando subsequentemente encontra o hospedeiro.No entanto, estas respostas imunes adaptativas desenvolveram-se lentamente.Konias et al.Mostra que o componente plaquetário contribui para a percepção de risco e reparação tecidual, e que a interação entre plaquetas e leucócitos promove a ativação da resposta imune adaptativa.
Durante a resposta imune adaptativa, as plaquetas promovem respostas de monócitos e macrófagos através da maturação das células DC e NK, levando a respostas específicas de células T e células B.Portanto, os componentes dos grânulos plaquetários afetam diretamente a imunidade adaptativa ao expressar CD40L, uma molécula essencial para regular a resposta imune adaptativa.As plaquetas através do CD40L não apenas desempenham um papel na apresentação do antígeno, mas também afetam a reação das células T.Liu et al.Verificou-se que as plaquetas regulam a resposta das células T CD4 de uma forma complexa.Esta regulação diferencial dos subconjuntos de células T CD4 significa que as plaquetas promovem as células T CD4 para responder a estímulos inflamatórios, produzindo assim fortes respostas pró-inflamatórias e anti-inflamatórias.
As plaquetas também regulam a resposta adaptativa mediada por células B a patógenos microbianos.É bem conhecido que o CD40L nas células T CD4 ativadas irá desencadear o CD40 das células B, fornecendo o segundo sinal necessário para a ativação de linfócitos B dependentes de células T, subsequente conversão de alótipos e diferenciação e proliferação de células B.Em geral, os resultados mostram claramente as várias funções das plaquetas na imunidade adaptativa, indicando que as plaquetas conectam a interação entre células T e células B através de CD40-CD40L, aumentando assim a resposta das células B dependente de células T.Além disso, as plaquetas são ricas em receptores de superfície celular, que podem promover a ativação plaquetária e liberar um grande número de moléculas inflamatórias e biologicamente ativas armazenadas em diferentes partículas plaquetárias, afetando assim a resposta imune inata e adaptativa.
Papel ampliado da serotonina derivada de plaquetas no PRP
A serotonina (5-hidroxitriptamina, 5-HT) tem um claro papel fundamental no sistema nervoso central (SNC), incluindo a tolerância à dor.Estima-se que a maior parte da 5-HT humana seja produzida no trato gastrointestinal e depois através da circulação sanguínea, onde é absorvida pelas plaquetas através do transportador de recaptação de serotonina e armazenada em partículas densas em alta concentração (65 mmol/L).O 5-HT é um neurotransmissor e hormônio bem conhecido que ajuda a regular vários processos neuropsicológicos no SNC (5-HT central).No entanto, a maior parte da 5-HT existe fora do SNC (5-HT periférica) e está envolvida na regulação das funções biológicas sistémicas e celulares de múltiplos sistemas orgânicos, incluindo sistemas funcionais cardiovasculares, pulmonares, gastrointestinais, urogenitais e plaquetários.A 5-HT tem metabolismo dependente da concentração em vários tipos de células, incluindo adipócitos, células epiteliais e glóbulos brancos.O 5-HT periférico também é um poderoso modulador imunológico, que pode estimular ou inibir a inflamação e afetar várias células do sistema imunológico através de seu receptor 5-HT específico (5HTR).
Mecanismo parácrino e autócrino de HT
A atividade do 5-HT é mediada pela sua interação com os 5HTRs, que é uma superfamília com sete membros (5-HT 1 – 7) e pelo menos 14 subtipos de receptores diferentes, incluindo o membro recentemente descoberto 5-HT 7, seu periférico e função no tratamento da dor.No processo de desgranulação plaquetária, as plaquetas ativadas secretam um grande número de 5-HT derivado de plaquetas, que pode promover a contração vascular e estimular a ativação de plaquetas e linfócitos adjacentes através da expressão de 5-HTR nas células endoteliais, células musculares lisas e células imunológicas.Pacala et al.O efeito mitótico da 5-HT nas células endoteliais vasculares foi estudado e foi determinado o potencial de promoção do crescimento de vasos sanguíneos danificados através da estimulação da angiogénese.Como esses processos são regulados não está completamente claro, mas pode envolver vias de sinalização bidirecionais diferenciais no microcircuito tecidual para regular as funções das células endoteliais vasculares e das células musculares lisas, fibroblastos e células imunológicas através de receptores 5-HT específicos nessas células. .A função autócrina da 5-HT plaquetária após a ativação plaquetária foi descrita [REF].A liberação de 5-HT aumenta a ativação de plaquetas e o recrutamento de plaquetas circulantes, levando à ativação de reações em cascata de sinal e efetores a montante que apoiam a reatividade plaquetária.
Efeito imunomodulador 5-HT
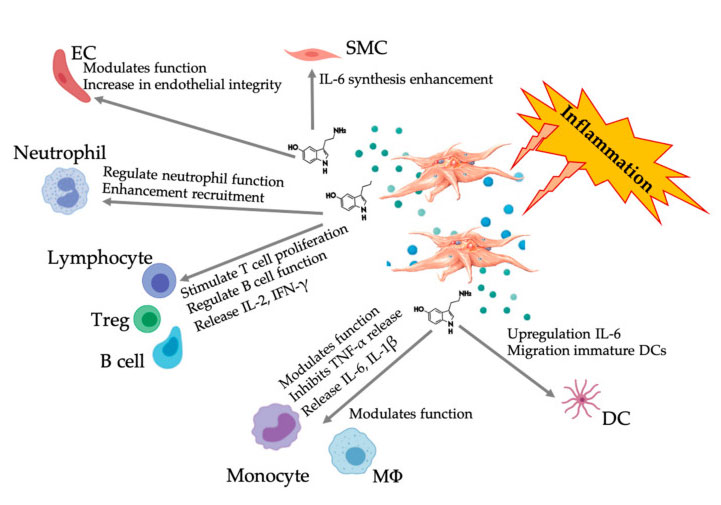
Cada vez mais evidências mostram que a serotonina pode desempenhar um papel em diferentes 5HTR como modulador imunológico.De acordo com o 5HTR expresso em vários leucócitos envolvidos na reação inflamatória, o 5-HT derivado de plaquetas atua como um regulador imunológico tanto no sistema imunológico inato quanto no adaptativo.A 5-HT pode estimular a proliferação de Treg e regular as funções das células B, células assassinas naturais e neutrófilos, recrutando DC e monócitos para o local inflamatório.Estudos recentes mostraram que a 5-HT derivada de plaquetas pode regular a função das células imunológicas sob condições específicas.Portanto, usando C-PRP, a concentração de plaquetas é superior a 1 × 10 6/µL pode ajudar significativamente a transportar a concentração de 5-HT derivada de plaquetas grandes para o tecido.No microambiente caracterizado por componentes inflamatórios, o PRP pode interagir com diversas células do sistema imunológico que desempenham papel fundamental nessas patologias, o que pode afetar os resultados clínicos.
Figura exibindo a resposta multifacetada do 5-HT após a ativação das plaquetas inflamatórias do PRP.Após a ativação das plaquetas, as plaquetas liberam seus grânulos, incluindo 5-HT em grânulos densos, que apresentam uma ampla gama de efeitos diferenciais em várias células do sistema imunológico, células endoteliais e células musculares lisas.Abreviaturas: SMC: células musculares lisas, CE: células endoteliais, Treg: linfócitos T convencionais, M Φ: Macrófagos, DC: células dendríticas, IL: interleucina, IFN- γ: Interferon γ。 Modificado e adaptado de Everts et al.e Hull et al.
Efeito analgésico do PRP
As plaquetas ativadas liberarão muitos mediadores pró-inflamatórios e antiinflamatórios, que podem não apenas causar dor, mas também reduzir a inflamação e a dor.Uma vez aplicada, a dinâmica plaquetária típica do PRP altera o microambiente antes da reparação e regeneração dos tecidos através de uma variedade de vias complexas relacionadas ao anabolismo e catabolismo, proliferação celular, diferenciação e regulação de células-tronco.Estas características do PRP levam à aplicação do PRP em diversas condições clínicas patológicas geralmente associadas à dor crónica (tais como lesões desportivas, doenças ortopédicas, doenças da coluna vertebral e feridas crónicas complexas), embora o mecanismo exacto não tenha sido totalmente determinado.
Em 2008, Evertz et al.É o primeiro ensaio clínico randomizado a relatar o efeito analgésico da preparação de PRP, que é preparado a partir da camada marrom da velocidade de hemossedimentação autóloga e ativado com trombina autóloga após cirurgia no ombro.Eles observaram uma redução significativa nas pontuações da escala visual analógica, o uso de analgésicos à base de opioides e uma reabilitação pós-operatória mais bem-sucedida.Vale ressaltar que eles refletem o efeito analgésico das plaquetas ativadas e especulam sobre o mecanismo de liberação de 5-HT pelas plaquetas.Resumindo, as plaquetas ficam dormentes no PRP recém-preparado.Após a ativação direta ou indireta das plaquetas (fator tecidual), as plaquetas mudam de forma e produzem falsos o suficiente para promover a agregação plaquetária.Então, eles liberam partículas α- e intracelulares densas.O tecido tratado com PRP ativado será invadido por PGF, citocinas e outros lisossomos plaquetários.Mais especificamente, quando as partículas densas libertam o seu conteúdo, libertam uma grande quantidade de 5-HT que regula a dor.No C-PRP, a concentração de plaquetas é 5 a 7 vezes maior que a do sangue periférico.Portanto, a liberação de 5-HT das plaquetas é astronômica.Curiosamente, Sprott et al.O relatório observou que a dor foi significativamente aliviada após acupuntura e moxabustão, a concentração de 5-HT derivado de plaquetas foi significativamente reduzida e, em seguida, o nível plasmático de 5-HT foi aumentado.
Na periferia, plaquetas, mastócitos e células endoteliais liberarão 5-HT endógeno durante lesão tecidual ou trauma cirúrgico.Curiosamente, uma variedade de receptores 5-HT de neurônios foi detectada na área periférica, o que confirmou que a 5-HT pode interferir na transmissão nociceptiva na área periférica.Estes estudos mostram que o 5-HT pode afetar a transmissão nociceptiva dos tecidos periféricos através dos receptores 5-HT1, 5-HT2, 5-HT3, 5-HT4 e 5-HT7.
O sistema 5-HT representa um sistema poderoso que pode reduzir e aumentar o grau de dor após estimulação prejudicial.A regulação central e periférica dos sinais nociceptivos e alterações no sistema 5-HT foram relatadas em pacientes com dor crônica.Nos últimos anos, um grande número de estudos centrou-se no papel da 5-HT e dos seus respectivos receptores no processamento e regulação de informações prejudiciais, resultando em medicamentos como os inibidores selectivos da recaptação da serotonina (ISRS).Esta droga inibe a recaptação da serotonina nos neurônios pré-sinápticos após a liberação da serotonina.Afeta a duração e a intensidade da comunicação da serotonina e é um tratamento alternativo para a dor crônica.Mais pesquisas clínicas são necessárias para compreender claramente o mecanismo molecular da regulação da dor 5-HT derivada do PRP em doenças crônicas e degenerativas.
Outros dados para resolver o potencial efeito analgésico do PRP podem ser obtidos após o teste do modelo analgésico em animal.As conclusões estatísticas comparativas nestes modelos são desafiadoras porque estes estudos contêm muitas variáveis.No entanto, alguns estudos clínicos abordaram os efeitos nociceptivos e analgésicos do PRP.Vários estudos demonstraram que pacientes que recebem tratamento para tendinose ou ruptura do manguito rotador apresentam pouco alívio da dor.Em contraste, vários outros estudos demonstraram que o PRP pode reduzir ou mesmo eliminar a dor de pacientes com degeneração tendínea, OA, fascite plantar e outras doenças do pé e tornozelo.A concentração final de plaquetas e a composição biológica das células foram identificadas como as principais características do PRP, que ajudam a observar o efeito analgésico consistente após a aplicação do PRP.Outras variáveis incluem método de entrega do PRP, tecnologia de aplicação, protocolo de ativação plaquetária, nível de atividade biológica de PGF e citocinas liberadas, tipo de tecido de aplicação de PRP e tipo de lesão.
Vale ressaltar que Kuffler resolveu o potencial do PRP no alívio da dor em pacientes com dor neuropática crônica leve a grave, secundária ao nervo não regenerativo danificado.O objetivo deste estudo é investigar se a dor neuropática pode ser reduzida ou diminuída devido ao PRP promovendo a regeneração axonal e a reinervação do nervo alvo.Surpreendentemente, entre os pacientes que recebem tratamento, a dor neuropática ainda é eliminada ou aliviada pelo menos seis anos após a cirurgia.Além disso, todos os pacientes começaram a aliviar a dor três semanas após a aplicação do PRP.
Recentemente, efeitos analgésicos semelhantes do PRP foram observados na área de feridas pós-operatórias e cuidados com a pele.Curiosamente, os autores relataram os aspectos fisiológicos da dor na ferida associada à lesão vascular e à hipóxia do tecido cutâneo.Eles também discutiram a importância da angiogênese na otimização da oxigenação e do fornecimento de nutrientes.O estudo mostrou que, em comparação com o grupo controle, os pacientes que receberam tratamento com PRP tiveram menos dor e aumentaram significativamente a angiogênese.Finalmente, Johal e seus colegas realizaram uma revisão sistemática e meta-análise e concluíram que o PRP pode reduzir a dor após o uso do PRP em indicações ortopédicas, especialmente em pacientes que recebem tratamento para epicondilite externa e OA de joelho.Infelizmente, este estudo não especificou os efeitos dos glóbulos brancos, da concentração plaquetária ou do uso de ativadores plaquetários exógenos, porque essas variáveis afetariam a eficácia global do PRP.A concentração ideal de plaquetas de PRP para o alívio máximo da dor não é clara.No modelo de tendinose em ratos, a concentração de plaquetas foi de 1,0 × 10 6 / μ Em L, a dor pode ser completamente aliviada, enquanto o alívio da dor causado pelo PRP com metade da concentração de plaquetas é significativamente reduzido.Portanto, encorajamos mais estudos clínicos para investigar os efeitos analgésicos de diferentes preparações de PRP.
Efeito PRP e angiogênese
As preparações de C-PRP na medicina regenerativa precisa permitem a entrega de biomoléculas liberadas por altas concentrações de plaquetas ativadas em locais de tecido-alvo.Portanto, uma variedade de reações em cascata foram iniciadas, que contribuem para a regulação imunológica local, o processo inflamatório e a angiogênese para promover a cura e o reparo tecidual.
A angiogênese é um processo dinâmico de várias etapas que envolve germinação e microvasos teciduais de vasos sanguíneos pré-existentes.A angiogênese progrediu devido a uma variedade de mecanismos biológicos, incluindo migração, proliferação, diferenciação e divisão de células endoteliais.Estes processos celulares são pré-requisitos para a formação de novos vasos sanguíneos.Eles são essenciais para o crescimento de vasos sanguíneos preexistentes para restaurar o fluxo sanguíneo e apoiar a alta atividade metabólica de reparação e regeneração tecidual.Esses novos vasos sanguíneos permitem o fornecimento de oxigênio e nutrientes e a remoção de subprodutos dos tecidos tratados.
A atividade da angiogênese é regulada pela estimulação do fator angiogênico VEGF e de fatores antiangiogênicos (por exemplo, angiostatina e trombospondina-1 [TSP-1]).No microambiente doente e degradado (incluindo baixa tensão de oxigénio, baixo pH e elevado nível de ácido láctico), os factores angiogénicos locais restaurarão a actividade da angiogénese.
Vários meios solúveis em plaquetas, como FGF básico e TGF-β e VEGF, podem estimular as células endoteliais a produzir novos vasos sanguíneos.Landsdown e Fortier relataram vários resultados relacionados à composição do PRP, incluindo as fontes intraplaquetárias de muitos reguladores angiogênicos.Além disso, concluíram que o aumento da angiogênese contribui para a cura da doença MSK em áreas com má vascularização, como ruptura de menisco, lesão de tendão e outras áreas com má vascularização.
Propriedades plaquetárias promotoras e antiangiogênicas
Nas últimas décadas, estudos publicados provaram que as plaquetas desempenham um papel fundamental na hemostasia primária, na formação de coágulos, na liberação de fatores de crescimento e citocinas e na regulação da angiogênese como parte do processo de reparo tecidual.Paradoxalmente, os grânulos do PRP α contêm um arsenal de fatores de crescimento pró-angiogênicos, proteínas antiangiogênicas e citocinas (como PF4, inibidor do ativador do plasminogênio-1 e TSP-1) e têm como alvo a liberação de fatores específicos que desempenham um papel .Papel na angiogênese.Portanto, o papel do PRP no controle da regulação da angiogênese pode ser definido pela ativação de receptores específicos da superfície celular, TGF-β iniciam reações pró-angiogênicas e antiangiogênicas.A capacidade das plaquetas de exercer a via da angiogênese foi confirmada na angiogênese patológica e na angiogênese tumoral.
Fator de crescimento angiogênico derivado de plaquetas e fator de crescimento antiangiogênico, derivado de moléculas α-E densas e adesivas.Mais importante ainda, é geralmente aceite que o efeito global das plaquetas na angiogénese é pró-angiogénico e estimulante.Espera-se que a terapia com PRP controle a indução da angiogênese, o que contribuirá para o efeito do tratamento de muitas doenças, como cicatrização de feridas e reparação de tecidos.A administração de PRP, mais especificamente a administração de PGF em alta concentração e outras citocinas plaquetárias, pode induzir angiogênese, angiogênese e arteriogênese, porque o fator 1a derivado de células estromais se liga ao receptor CXCR4 nas células progenitoras endoteliais.Bill et al.Sugere-se que o PRP aumente a neovascularização isquêmica, o que pode ser devido à estimulação da angiogênese, angiogênese e arteriogênese.No seu modelo in vitro, a proliferação de células endoteliais e a formação de capilares foram induzidas por um grande número de diferentes PDGs, dos quais o VEGF foi o principal estimulador angiogénico.Outro fator importante e essencial para restaurar a via da angiogênese é a sinergia entre múltiplas PGFs.Richardson et al.Foi provado que a atividade sinérgica do fator de crescimento derivado de plaquetas angiogênico-bb (PDGF-BB) e do VEGF levou à rápida formação de uma rede vascular madura em comparação com a atividade do fator de crescimento individual.O efeito combinado desses fatores foi recentemente confirmado em um estudo sobre o aumento da circulação colateral cerebral em camundongos com hipoperfusão prolongada.
Mais importante ainda, um estudo in vitro mediu o efeito proliferativo de células endoteliais da veia umbilical humana e várias concentrações de plaquetas na seleção do dispositivo de preparação de PRP e na estratégia de dose de plaquetas, e os resultados mostraram que a dose ideal de plaquetas foi de 1,5 × 10 6 plaquetas/ μ 50. Para promover a angiogênese.Concentrações plaquetárias muito altas podem inibir o processo de angiogênese, portanto o efeito é fraco.
Envelhecimento celular, envelhecimento e PRP
A senescência celular pode ser induzida por vários estímulos.Este é um processo no qual as células param de se dividir e sofrem alterações fenotípicas únicas para impedir o crescimento irrestrito de células danificadas, o que desempenha um papel importante na prevenção do cancro.No processo de envelhecimento fisiológico, o envelhecimento da replicação celular também promoverá o envelhecimento celular e a capacidade de regeneração das MSCs será reduzida.
Efeitos do envelhecimento e envelhecimento celular
In vivo, muitos tipos de células envelhecem e acumulam-se em vários tecidos durante o envelhecimento, entre os quais existe um grande número de células envelhecidas.O acúmulo de células envelhecidas parece aumentar com o aumento da idade, danos ao sistema imunológico, danos aos tecidos ou fatores relacionados ao estresse.O mecanismo de envelhecimento celular tem sido identificado como o fator patogênico de doenças relacionadas à idade, como osteoartrite, osteoporose e degeneração do disco intervertebral.Uma variedade de estímulos agravará o envelhecimento celular.Em resposta, o fenótipo secretor relacionado à senescência (SASP) secretará altas concentrações de células proteicas e citocinas.Este fenótipo especial está relacionado ao envelhecimento das células, nas quais elas secretam altos níveis de citocinas inflamatórias (como IL-1, IL-6, IL-8), fatores de crescimento (como TGF-β, HGF, VEGF, PDGF), MMP e catepsina.Em comparação com os jovens, foi comprovado que o SAPS aumenta com a idade, porque o processo de estado estacionário é destruído, resultando no envelhecimento celular e na redução da capacidade de regeneração.Especificamente, em doenças articulares e musculares esqueléticas.Nesse sentido, o envelhecimento imunológico é considerado uma alteração significativa no espectro de secreção das células imunes, indicando que a concentração de TNF-a, IL-6 e/ou Il-1b aumenta, levando à inflamação crônica de baixo grau.Vale ressaltar que a disfunção das células-tronco também está relacionada a mecanismos autônomos não celulares, como o envelhecimento das células, principalmente a produção de fatores pró-inflamatórios e anti-regenerativos através do SASP.
Pelo contrário, o SASP também pode estimular a plasticidade celular e a reprogramação de células adjacentes.Além disso, o SASP pode organizar a comunicação com vários mediadores imunológicos e ativar células imunológicas para promover a eliminação das células envelhecidas.Compreender o papel e a função das células envelhecidas contribuirá para a cicatrização e remodelação dos tecidos dos músculos MSK e feridas crónicas.
Vale ressaltar que Ritcka et al.Um extenso estudo foi realizado, e o papel principal e benéfico do SASP na promoção da plasticidade celular e da regeneração tecidual foi descoberto, e o conceito de tratamento transitório de células envelhecidas foi introduzido.Mencionaram cautelosamente que o envelhecimento é principalmente um processo benéfico e regenerativo.
Envelhecimento celular e potencial do PRP
À medida que o número de células-tronco diminui, o envelhecimento afetará o desempenho das células-tronco.Da mesma forma, em humanos, as características das células estaminais (tais como secura, proliferação e diferenciação) também diminuem com a idade.Wang e Nirmala relataram que o envelhecimento reduziria as características das células-tronco das células tendinosas e o número de receptores de fatores de crescimento.Um estudo em animais mostrou que a concentração de PDGF em cavalos jovens era elevada.Eles concluíram que o aumento no número de receptores GF e no número de GF em indivíduos jovens pode ter uma resposta celular melhor ao tratamento com PRP do que indivíduos mais velhos em indivíduos jovens.Estas descobertas revelam porque o tratamento com PRP pode ser menos eficaz ou mesmo ineficaz em pacientes idosos com menos células estaminais e “má qualidade”.Está provado que o processo de envelhecimento da cartilagem é revertido e o período de repouso dos condrócitos aumenta após a injeção de PRP.Jia et al.É usado para estudar o fotoenvelhecimento in vitro de fibroblastos dérmicos de camundongos, com e sem tratamento com PRP, para esclarecer o mecanismo de contra-ação do PGF neste modelo.O grupo PRP apresentou efeito direto na matriz extracelular, aumentou o colágeno tipo I e diminuiu a síntese de metaloproteinases, indicando que o PRP pode neutralizar o envelhecimento celular, e também na doença degenerativa MSK.
Em outro estudo, o PRP foi usado para coletar células-tronco envelhecidas da medula óssea de camundongos idosos.Foi determinado que o PRP pode recuperar uma variedade de funções das células-tronco do envelhecimento, como a proliferação celular e a formação de colônias, e reconstruir os marcadores relacionados ao envelhecimento celular.
Recentemente, Oberlohr e seus colegas estudaram extensivamente o papel do envelhecimento celular no enfraquecimento da regeneração muscular e avaliaram o PRP e o plasma pobre em plaquetas (PPP) como opções de tratamento biológico para a reparação do músculo esquelético.Eles imaginaram que o tratamento com PRP ou PPP para reparo do músculo esquelético seria baseado em fatores biológicos personalizados para marcadores celulares específicos do SASP e outros fatores que levam ao desenvolvimento de fibrose.
É razoável acreditar que antes da aplicação do PRP, o envelhecimento celular direcionado pode melhorar as características de regeneração da eficácia do tratamento biológico, reduzindo os fatores locais de SASP.Foi sugerido que outra opção para melhorar os resultados do tratamento com PRP e PPP para a regeneração do músculo esquelético é remover seletivamente as células envelhecidas com eliminadores de envelhecimento.Não há dúvida de que os resultados de pesquisas recentes sobre o efeito do PRP no envelhecimento e envelhecimento celular são fascinantes, mas ainda estão em estágio inicial.Portanto, não é razoável fazer qualquer sugestão neste momento.
(O conteúdo deste artigo foi reimpresso e não fornecemos nenhuma garantia expressa ou implícita quanto à exatidão, confiabilidade ou integridade do conteúdo contido neste artigo e não somos responsáveis pelas opiniões deste artigo, por favor, entenda.)
Horário da postagem: 01/03/2023