O papel das plaquetas no concentrado de aspiração de medula óssea
O PRP e o concentrado de aspiração de medula óssea (BMAC) estão sendo usados para uma série de tratamentos clínicos em ambiente de consultório e cirurgia devido aos seus benefícios regenerativos em MSK e doenças da coluna vertebral, controle da dor crônica e indicações de tecidos moles.O PRP não apenas regula a migração e a proliferação celular, mas também contribui para a angiogênese e a remodelação da MEC para criar um microambiente favorável e promover a reparação e regeneração tecidual.
Processo de reparo BMAC
BMACs são composições celulares heterogêneas contendo BMMSCs, tornando-as uma fonte celular endógena para terapia de reparo de medicina regenerativa.Desempenham um papel na redução da apoptose celular, fibrose e inflamação;E ativa a reação em cascata que leva à proliferação celular.Além disso, as BMMSCs têm potencial para se diferenciar em uma variedade de linhagens celulares, incluindo osteoblastos, adipócitos, mioblastos, células epiteliais e neurônios.Eles também promovem a angiogênese através de vias parácrinas e autócrinas.É também importante que o BMMSC contribua para a regulação imunitária independente de células imunoespecíficas, que participam na fase inflamatória da reparação de feridas.Além disso, os BMMSCs apoiam o recrutamento de células para novos locais de tratamento de angiogênese para acelerar a reconstrução do fluxo sanguíneo local.Jin et al.Ficou provado que, na ausência de estruturas suficientes, a taxa de sobrevivência do BMMSC e a sua capacidade de reparação e diferenciação para promover a cura foram prejudicadas.Embora a coleta de tecidos, o preparo da amostra e o mecanismo de ação do PRP e do BMAC sejam diferentes, estudos mostram que eles podem se complementar.Na verdade, combinar PRP e BMAC num produto biológico pode ter vantagens adicionais.
Combinando PRP e BMAC
De acordo com algumas pesquisas pouco conhecidas, o princípio básico da combinação de PRP e BMAC baseia-se em diversas premissas.Primeiro, o PRP pode fornecer um microambiente adequado no qual o BMSC pode aumentar a proliferação e diferenciação celular e aumentar a angiogênese.Em segundo lugar, o PRP tem sido utilizado como suporte para estas células juntamente com o BMAC.Pelo contrário, a combinação de PRP e BMAC pode tornar-se uma poderosa ferramenta biológica para atrair a população de BMMSC.O composto PRP-BMAC tem sido utilizado no tratamento de tendinose, feridas, lesões medulares, discos intervertebrais degenerativos e defeitos osteocondrais com grande potencial de regeneração.Infelizmente, embora os componentes heterogêneos das células da medula óssea incluam plaquetas, poucos relatos mencionam a concentração de plaquetas na medula óssea extraída e após o tratamento com BMAC, mas podem ser extraídas por métodos de aspiração apropriados.Mais pesquisas são necessárias para entender se concentrados adicionais de plaquetas precisam ser usados em combinação com BMAC.Actualmente, não existem dados sobre a proporção ideal de plaquetas para células MSC (ou outras células da medula óssea), o que tem um impacto positivo no mecanismo nutricional das MSC na reparação tecidual.Idealmente, o equipamento e a tecnologia de colheita de medula óssea podem ser otimizados para extrair plaquetas de medula óssea suficientes.
Fator de crescimento PRP e efeito nutricional BMAC
O fator de crescimento plaquetário PRP é uma proteína chave envolvida no processo de reparo do BMAC.A diversidade de PGF e outras citocinas envolvidas no processo nutricional do BMAC pode iniciar o reparo tecidual reduzindo a apoptose celular, o anabolismo e os efeitos antiinflamatórios, e ativando a proliferação, diferenciação e angiogênese celular através de vias parácrinas e autócrinas.
O fator de crescimento derivado de plaquetas e os componentes granulares densos estão obviamente envolvidos no processo nutricional do BMAC e apoiam a reparação e regeneração tecidual induzida pelas MSC.Abreviaturas: MSC: células-tronco mesenquimais, HSC: células-tronco hematopoiéticas.
Obviamente, no tratamento da OA, o PDGF desempenha um papel específico na regeneração da cartilagem e na manutenção da homeostase através da proliferação de MSC e da inibição da apoptose e inflamação dos condrócitos induzida por IL-1.Além disso, três subtipos de TGF-β são ativos na estimulação da formação de cartilagem e na inibição da inflamação, e mostram a capacidade de promover a cicatrização de tecidos relacionados às MSC por meio da interação intermolecular.O efeito nutricional das CTM está relacionado à atividade da PGF e à secreção de citocinas de reparo.Idealmente, todas estas citocinas devem estar presentes no frasco de tratamento BMAC e transportadas para o local da lesão tecidual para promover a melhor cicatrização tecidual terapêutica relacionada às MSC.
Num estudo conjunto de OA, Muiñ os-Ló pez et al.Mostra que as CTM derivadas do tecido sinovial alteraram a função, resultando na perda da sua capacidade de recuperação.Curiosamente, a injeção direta de PRP no osso subcondral da osteoartrite resultou na redução de MSC no líquido sinovial, indicando melhora clínica.O efeito terapêutico é mediado pela redução do processo inflamatório no líquido sinovial de pacientes com OA.
Há pouca informação disponível sobre a presença ou concentração de PGF no BMAC ou a proporção ideal necessária para apoiar a função nutricional do BMMSC.Alguns médicos combinam altas concentrações de PRP com BMAC para obter enxertos mais biologicamente ativos, o que se espera otimizar os resultados do tratamento da medicina regenerativa.No entanto, existem poucos dados de segurança e eficácia disponíveis, indicando que a combinação de altas concentrações de PRP com BMAC é uma opção de tratamento mais eficaz.Portanto, acreditamos que pode não ser apropriado manipular BMMSC ativando-os com alta concentração de plaquetas nesta fase.
Interação de plaquetas com medicamentos antiplaquetários e AINEs
O PRP contém um amplo espectro de componentes secretores e é composto por muitos meios biológicos.O efeito terapêutico do PRP é atribuído a estes mediadores.Embora os mediadores terapêuticos nas plaquetas sejam bem conhecidos, a formulação e a cinética ideais destas drogas anabólicas e catabólicas não são completamente claras.Uma das principais limitações na obtenção de formulações terapêuticas é superar a variabilidade destes mediadores biológicos, a fim de atingir os efeitos a jusante bem regulados que são sempre repetíveis e clinicamente benéficos.Por esta razão, medicamentos (como antiinflamatórios não esteróides (AINEs)) podem afetar a liberação de grupos secretores de plaquetas.Em um recente estudo aberto de sequência fixa, a ingestão diária de 81 mg de aspirina (AAS) reduziu a expressão de mediadores-chave, como TGF-β 1, PDGF e VEGF.
Esses efeitos são atribuídos à inibição irreversível da ciclooxigenase-1 (COX-1) e à inibição ajustável da ciclooxigenase-2 (COX-2), que são duas enzimas necessárias para a desgranulação plaquetária a jusante.Uma revisão sistemática recente descobriu que os medicamentos antiplaquetários podem reduzir a curva de liberação do fator de crescimento de maneira dependente da COX-1 e COX-2, e 8 dos 15 estudos descobriram que os fatores de crescimento diminuíram.
Medicamentos (por exemplo, AINEs) são geralmente usados para aliviar a dor e reduzir a inflamação causada pela doença MSK.O mecanismo dos AINEs é inibir a ativação plaquetária ligando-se irreversivelmente à enzima COX e regulando a via do ácido araquidônico.Portanto, a função das plaquetas irá mudar durante todo o ciclo de vida das plaquetas, impedindo assim a transmissão do sinal PGF.Os AINEs inibem a produção de citocinas (por exemplo, PDGF, FGF, VEGF e IL-1 β, IL-6 e IL-8), ao mesmo tempo que aumentam o TNF-α. No entanto, há poucos dados sobre o impacto molecular dos AINEs no PRP.Não há consenso sobre o melhor momento para o preparo e administração do PRP em pacientes que utilizam AINEs.Mannava e colegas quantificaram os fatores biológicos anabólicos e catabólicos no PRP rico em leucócitos de voluntários saudáveis que tomaram naproxeno.Eles descobriram que depois de usar naproxeno durante uma semana, os níveis de PDGF-AA e PDGF-AB (mitógeno eficaz para promover a angiogênese) foram significativamente reduzidos.Após uma semana, o nível do factor de crescimento regressou próximo do nível da linha de base.Após o uso de naproxeno por uma semana, o nível de LR-PRP do fator pró-inflamatório e catabólico IL-6 também diminuiu e retornou ao nível basal após um período de depuração de uma semana.Atualmente, não há estudo clínico que comprove que pacientes com naproxeno após tratamento com PRP apresentem resultados negativos;No entanto, recomenda-se considerar um período de lavagem de uma semana para restaurar os valores de PDGF-AA, PDGF-BB e IL-6 ao nível basal para melhorar a sua atividade biológica.Mais pesquisas são necessárias para compreender completamente os efeitos dos antiplaquetários e dos AINEs no grupo de secreção do PRP e seus alvos a jusante.
Combine a aplicação de plasma rico em plaquetas com reabilitação
Embora a pesquisa científica básica mostre que a fisioterapia e a carga mecânica têm um papel claro na recuperação da estrutura do tendão após a injeção de PRP, não há consenso sobre o melhor plano de reabilitação para a doença MSK após o tratamento com PRP.
O tratamento com PRP inclui injeção de plaquetas concentradas no ambiente tecidual local para regular a dor e promover a reparação tecidual.A evidência clínica mais forte existe na OA de joelho.Porém, o uso do PRP no tratamento da tendinose sintomática é controverso e os resultados relatados são diferentes.Estudos em animais geralmente mostram melhora histológica da tendinose após infiltração de PRP.Esses estudos mostram que a carga mecânica pode regenerar os tendões, e a carga e a injeção de PRP trabalham juntas para promover a cicatrização do tendão.Diferenças nas preparações de PRP, preparações biológicas, preparações, esquemas de injeção e subtipos de lesões nos tendões podem levar a diferenças nos resultados clínicos.Além disso, embora as evidências científicas apoiem os benefícios dos planos de reabilitação, poucas investigações clínicas publicadas tentam gerir e integrar planos de reabilitação pós-PRP consistentes.
Recentemente, Onishi et al.O papel da carga mecânica e do efeito biológico do PRP na doença do tendão de Aquiles foi revisado.Eles avaliaram os estudos clínicos de fase I e fase II da doença do tendão de Aquiles tratada com PRP, com foco no plano de reabilitação após a injeção de PRP.Os programas de reabilitação supervisionados parecem melhorar a adesão ao exercício e melhorar os resultados e a capacidade de monitorar a dose de exercício.Vários ensaios bem elaborados de PRP no tendão de Aquiles combinaram o tratamento pós-PRP com um plano de reabilitação de carga mecânica como parte integrante da estratégia de regeneração.
Perspectivas futuras e conclusões
O progresso técnico dos equipamentos e métodos de preparação do PRP mostra resultados promissores para os pacientes, embora a definição dos diferentes agentes biológicos do PRP e as características biológicas relevantes do produto final ainda sejam inconclusivas.Além disso, o potencial total das indicações e aplicações do PRP não foi determinado.Até recentemente, o PRP era vendido comercialmente como um produto derivado do sangue autólogo, o que pode fornecer aos médicos a capacidade de usar a tecnologia do fator de crescimento plaquetário autólogo em patologias e doenças específicas indicadas.A princípio, o único critério para sucesso na aplicação do PRP frequentemente citado é a amostra preparada, cuja concentração de plaquetas é superior ao valor do sangue total.Hoje, felizmente, os profissionais têm uma compreensão mais abrangente do funcionamento do PRP.
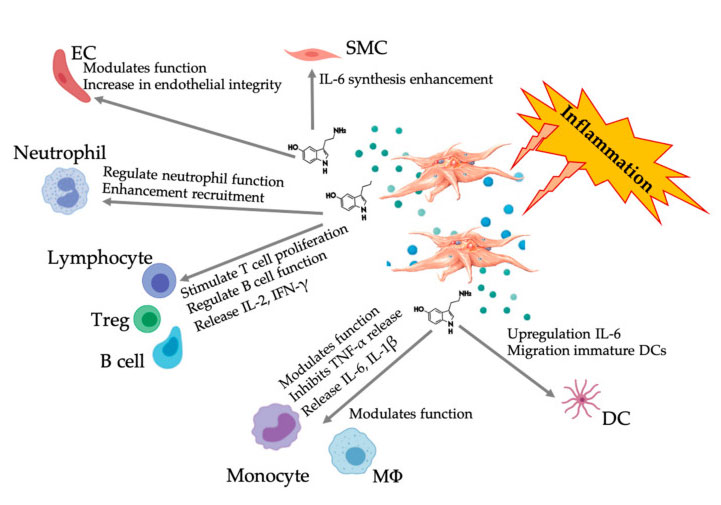
Nesta revisão, reconhecemos que ainda falta padronização e classificação na tecnologia de preparo;Portanto, não há consenso sobre os agentes biológicos do PRP no momento, embora mais literatura tenha chegado a um acordo sobre a concentração eficaz da dose plaquetária necessária para promover a (nova) angiogênese.Aqui, introduzimos brevemente a atividade das PGFs, mas refletimos de forma mais ampla o mecanismo específico das plaquetas e o efeito efetor dos glóbulos brancos e das MSCs, bem como a subsequente interação célula-célula.Em particular, a presença de glóbulos brancos nas preparações de PRP proporciona uma compreensão mais profunda dos efeitos prejudiciais ou benéficos.O claro papel das plaquetas e sua interação com os sistemas imunológicos inato e adaptativo têm sido discutidos.Além disso, são necessários estudos clínicos suficientes e bem documentados para determinar todo o potencial e efeito terapêutico do PRP em diversas indicações.
(O conteúdo deste artigo foi reimpresso e não fornecemos nenhuma garantia expressa ou implícita quanto à exatidão, confiabilidade ou integridade do conteúdo contido neste artigo e não somos responsáveis pelas opiniões deste artigo, por favor, entenda.)
Horário da postagem: 01/03/2023